新聞及香港科大故事
2021
新聞
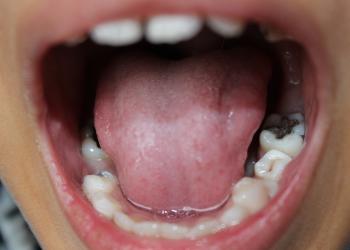
科大破解人類口腔微生物小分子促進牙菌膜形成的奧秘
由香港科技大學(科大)海洋科學系及生命科學部講座教授錢培元帶領的一支跨學科研究團隊,揭示了人類口腔變形鏈球菌(Streptococcus mutans)釋放出的新型微生物小分子與蛀牙的形成有關,為人類口腔微生物群對健康的影響提供了新的科學證據,推動了未來預防蛀牙的研究。該研究成果已發表在權威前沿科學雜誌Nature Chemical Biology,並獲Nature以亮點研究進行報道。
生物膜(biofilm)是由細菌胞外大分子包裹的細菌群體組成;地球上每一個濕潤的表面都被生物膜所覆蓋。美國國家衛生研究院(National Institutes of Health)早期研究表明,超過80%的人類細菌感染是由生物膜引起的。 變形鏈球菌是生存在人類口腔的主要天然菌,它可以形成生物膜和產生有機酸,所以一直被認為是導致蛀牙的主要原因。
蛀牙一向被列為是人類最常見的慢性細菌感染疾病之一,且治療費用昂貴。全球每年用於治療蛀牙的經濟支出高達數十億美元1 。蛀牙的發展是一個複雜的過程,主要依賴於牙齒表面微生物生物膜(又稱為牙菌膜)的形成。雖然變形鏈球菌中與生物膜形成和發展有關的大分子已被廣泛研究,但小分子次生代謝產物在這種細菌生物膜形成中的作用仍未被深入探究。
錢教授的研究團隊致力於運用基因組學、轉錄組學和化學生物學的方法,研究生物膜的訊號分子如何調控微生物及動物間的相互作用。最近,該團隊將生物膜研究拓展到公共衛生領域。

新聞
香港科大首次破解深海海底熱泉神盾螺共生體基因組
由香港科技大學海洋科學系系主任及講座教授暨捷成David von Hansemann 理學教授錢培元領導的研究團隊,於《自然· 通訊》期刊發表了有關海底熱泉一種無脊椎動物—神盾螺共生體運作機制的最新研究成果。 該研究不僅發現神盾螺食道腺(消化系統)中同時存在硫氧化細菌和甲烷氧化細菌兩種共生菌,更首次破解這兩種共生菌及宿主神盾螺的基因組,揭示了共生體利用化學能量生產營養物質的過程以及適應極端環境的分子機制,為地球生命的起源提供了新的啟示。海底熱泉具有極高靜水壓且黑暗無光,熱泉噴口所噴出經地熱加熱過的水,高達幾百攝氏度,其中還包含很多有毒的重金屬元素和化學物質,是一個典型、獨特且極端的生態環境。熱泉噴口的形成與海底岩漿的活動有關。一直以來,關於地球生命的起源有多種假說,其中較主流的為生命起源自深海的海底熱泉。海底熱泉與地球上絕大部分依靠植物光合作用的生態系統不同,化能合成細菌是這個生態系統的初級生產者,通過利用化學物質的化學能量轉換成有機物,從而孕育了海底熱泉生態系統中豐富而獨特的生物和基因資源。然而,這些生物如何適應海底熱泉這個極端環境卻一直是未解之謎。2019年4月和5月,錢培元教授團隊在西南印度洋的龍旂海底熱泉,利用無人潛航器進行了深潛作業,對由中國首次發現並命名的龍旂海底熱泉進行科學考察,下潛深度約2800米。在龍旂海底熱泉,生活著一種群體龐大的物種神盾螺,因其足部有一片類似盾牌的殼片而得名。該團隊發現,在神盾螺食道腺細胞內存在兩種形態不同的內共生細菌,分別為硫氧化細菌和甲烷氧化細菌。
2020

新聞
構建香港智慧城市(只供英文版本)
Prof. CHEN Kai, Associate Professor of Computer Science and Engineering, is now the brain behind what will become Hong Kong’s ‘brain’ in future – the next-generation artificial intelligence (AI) computing hub for the entire city that encompasses smart bus schedules, taxi dispatch, typhoon warning, medical diagnosis, fintech and others.

新聞
科大發現阿爾茲海默症治療新靶標
香港科技大學(科大)研究團隊利用了一個研究大腦的嶄新方法,不但有助評估潛在藥物對阿爾茲海默症(AD)患者的作用,更因而發現了治療AD的新靶標,為阿爾茲海默症的研究及藥物開發開闢新路徑。
葉玉如教授 (左二)及其研究團隊。
阿爾茲海默症的病理機制研究已開展了數十年,但至今仍未有有效的治療方法。傳統的研究方法在判斷分子靶標是否可應用於藥物開發方面存有一定的局限性。例如在分子和病理研究中,AD患者腦部會被當作一個整體進行分析,但不同類型的腦細胞以及其異變對AD的作用,卻往往因此而被忽視,尤其是一些數量較少、例如僅佔腦細胞總數5%的小膠質細胞及1%的內皮細胞等。
由科大研究與發展副校長、分子神經科學國家重點實驗室主任及生命科學部晨興教授葉玉如領導的研究團隊,近日不僅解決了這個問題,更同時在內皮細胞和小膠質細胞發現了多個潛在的新分子靶標,可用於開發治療AD的藥物。
葉教授的團隊利用先進的單細胞轉錄組分析技術,分析AD患者遺體大腦中特定細胞的功能。這項技術讓研究人員在單細胞水平上追蹤傳統工具無法觀測到的大腦分子變化。研究團隊對AD患者大腦中特定細胞的轉錄組變化作了全面分析,找到與AD相關的細胞亞型和病理途徑,並發現在大腦血管中內皮細胞亞群的作用。研究首次發現血管自然的增新程序和內皮細胞亞群中的免疫激活與AD的發病機理有關連,顯示血管失調與阿爾茲海默症之間存在聯繫。研究還發現了新型分子靶標,有助恢復AD患者的神經動態平衡。
新聞
揭示不同硬度基質中轉移性癌細胞的新機制
癌細胞轉移是指癌細胞從原發性腫瘤擴散到不同的身體部位,是癌症發展中最致命的階段。當癌細胞脫離原發性腫瘤並進入血液或淋巴系統時,它們就可以轉移到身體各個地方,在新的擴散組織中增生從而形成繼發性腫瘤。百分之九十的癌症死亡個案就是由癌細胞轉移導致。
癌細胞在轉移過程中會主動與周圍的微環境互動,而這種作用機制尚未被闡明,這使得轉移癌細胞如何應對繼發組織中的新環境成為癌症研究中的一個關鍵問題。最近,香港科技大學(科大)的研究人員及其國際合作者發現了一種轉移性癌細胞在不同硬度基質上的新回應和適應機制,這一研究結果將有助於開發用於轉移性癌細胞的診斷工具和癌症治療。
這項研究結果已在2020年9月18日的《物理化學快報》上發表。
在這項研究中,由科大物理系和生命科學部助理教授朴孝根帶領的研究團隊採用聚丙烯酰胺(PAA)基質模擬了從腦到骨骼的各種組織的硬度,並利用先進的螢光共振能量轉移成像技術和朴教授的研究團隊組建的磁鑷平臺對單個轉移性乳腺癌細胞(MDA-MB-231)對不同硬度的回應和適應機制進行了研究。









